PNO - Cục Quản lý Thực phẩm và Dược phẩm (FDA) từ chối phê duyệt vắc xin COVID-19 của AstraZeneca vào Mỹ.
| Chia sẻ bài viết: |

Ngày 12/3, các quan chức cho biết 1 chiếc xe buýt đã gặp tai nạn nghiêm trọng trên đường cao tốc Jaime Mendoza Diagonal, giữa thị trấn Soratariri và Tomaycuri.

Đan, móc, may vá, chơi mạt chược… là những hoạt động giải trí thường thấyở tuổi già. Nhưng giờ đây, sở thích của các “ông bà” được nhiều người trẻ yêu thích.

Luật mới tại Nhật Bản yêu cầu các công ty phải thực hiện những biện pháp giúp bảo vệ nhân viên trước khách hàng xấu tính.

Nghiên cứu từ Anh cho thấy, biến đổi khí hậu ảnh hưởng cực đoan đến thời tiết các thành phố lớn nhất thế giới, theo hướng quá ẩm hoặc quá khô.
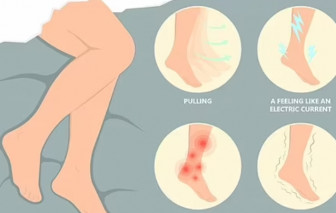
Các bác sĩ cảnh báo rằng một loại thuốc phổ biến được sử dụng để điều trị chứng rối loạn vận động có thể gây ra hành vi tình dục lệch lạc.

TikToker béo phì nổi tiếng với việc chia sẻ các video ăn uống vô độ, đã qua đời ở tuổi 24 vì các vấn đề sức khỏe liên quan đến cân nặng.

Ngày 12/3, Argentina đã bắt đầu phiên tòa xét xử nhóm bác sĩ của ngôi sao bóng đá Diego Maradona - người đã qua đời năm 2020.

Bệnh nhân ngoài 40 tuổi được cấy ghép tim nhân tạo do Úc thiết kế, giúp người này sống sót hơn 100 ngày trong thời gian chờ tim hiến tặng.

Câu chuyện của người phụ nữ ở Giang Tô (Trung Quốc) đã thu hút 190 triệu lượt xem khi chia sẻ trên mạng xã hội.

6 trong số 10 thành phố ô nhiễm nhất thế giới nằm ở Ấn Độ, trong khi California có tình trạng ô nhiễm không khí tồi tệ nhất ở Bắc Mỹ.

Văn phòng Tổng thống Ukraine cho biết Kiev sẵn sàng chấp nhận đề xuất của Washington về việc thực hiện ngay một lệnh ngừng bắn tạm thời trong 30 ngày.

Khoảng 1/7 trẻ em và thanh thiếu niên từ 10-19 tuổi trên thế giới đang bị ảnh hưởng bởi các vấn đề về sức khỏe tâm thần.

Nhân viên tại sân bay quốc tế Newark Liberty (Mỹ) phát hiện 1 người đàn ông đang cố gắng lén mang 1 con rùa sống lên máy bay.

Các chiến binh ly khai đã tấn công và chiếm giữ 1 chuyến tàu ở tỉnh Balochistan, tây nam Pakistan, bắt hàng trăm người làm con tin.

Một số công đoàn lao động Trung Quốc đã ban hành thông báo chính thức tới các công ty, yêu cầu ngừng hỏi về tình trạng hôn nhân của lao động nữ.

Các bác sĩ cảnh báo hàng triệu phụ nữ có thể đang sống chung với tình trạng sức khỏe âm thầm khiến họ có nguy cơ đột quỵ và đau tim.

Mặc dù nổi tiếng là một đất nước an toàn nhất thế giới nhưng phần lớn người dân Nhật Bản lại cảm thấy xã hội ngày càng không an toàn.

Nghiên cứu mới cho thấy 'bộ não TikTok' do nghiện video ngắn trên mạng xã hội có ảnh hưởng đến tâm trạng, khả năng học tập và trí nhớ.